
امروز جمعه ۲۱ اردیبهشت ۱۴۰۳
دسته بندی سایت
برچسب های مهم
پیوند ها
آمار بازدید سایت

چکیده
شیگلا فلکسنری یک باکتری گرم منفی است که باعث انتقال بیشتر اسهال خونی باکتریایی، شیگلوزیس میشود. شیگلوزیس باعث ۱ / ۱ میلیون مرگ و بیش از ۱۶۴ میلیون مورد در هر سال میشود، با اکثریت مواردی که در کودکان کشورهای در حال توسعه رخ میدهد. پاتوژنز شیگلا فلکسنری براساس توانایی باکتریها در تهاجم و تکثیر در داخل اپیتلیوم روده است که منجر به التهاب شدید و تخریب اپی تلیال میشود. مکانیسمهای مولکولی استفادهشده توسط شیگلا flexneri برای عبور از سد اپی تلیال , گریز از پاسخ ایمنی میزبان و ورود به سلولهای اپی تلیال به طور گسترده در هر دو مدل in vitro و in vivo مورد مطالعه قرار گرفتهاند . به طور خلاصه، چندین فاکتور ویرولانس ضروری برای تهاجم باکتری، گسترش بین سلولی و القای التهاب در شیگلا فلکسنری وجود دارد .. التهاب تولید شده توسط میزبان هم در تخریب اپیتلیوم روده و هم در کنترل و مهار عفونت شیگلا دخیل است. پاسخ هومورال میزبان به شیگلا فلکسنری نیز در حفاظت از میزبان مهم به نظر میرسد، در حالی که نقش پاسخ ایمنی سلولی نامشخص باقی میماند. پاسخ ایمنی میزبان به شیگلوزیس اختصاصی سروتایپ است و در برابر عفونت مجدد توسط همان سروتایپ محافظت میکند و واکسیناسیون را ممکن میسازد. از دهه ۱۹۴۰ واکسن شیگلا فلکسنری با موفقیت کمی تولید شد، با این حال، درک رو به رشد از پاتوژنز شیگللا فلکسنری و پاسخ ایمنی میزبان به تولید استراتژیهای بهتر واکسن کمک میکند. تحقیق حاضر انواع مختلفی از واکسن را در بر میگیرد که با وجود اختلاف در کارایی و ایمنی آنها در انسان، پیشرفت امیدوارکنندهای را در ساخت واکسن شیگلا فلکسنری نشان میدهد.
۱. مقدمه
اعضای جنس شیگلا بیهوازی های اختیاری گرم منفی هستند که به خانواده انتروباکتریاسه تعلق دارند . آنها ویژگیهای مشترکی را با اعضای این جنس به اشتراک میگذارند و ارتباط ژنتیکی به وضوح نشان میدهد که آنها یکسای تایپ از اشرشیا کلی هستند. این جنس به چهار گونه، شیگلا فلکسنری، شیگلا بوییدی، شیگلا سونئی و شیگلا دیسانتری تقسیم میشود. این گونهها بعدا براساس تفاوتهای بیوشیمیایی و تنوع در آنتی ژن خود به سروتایپ ها تقسیم میشوند. براساس این طرح طبقهبندی , شیگلا flexneri به 13 سروتایپ تقسیم میشود .
گونههای شیگلا اپیلیوم روده و کولون پستانداران و انسانها حمله میکنند و باعث التهاب حاد مخاطی شیگلوزیس میشوند. عفونت معمولا به لایه سطحی مخاط روده محدود میشود که در آن آسیب شدید بافتی منجر به آبسه و زخم میشود. تخریب لایه اپیتلیال منجر به علائم بالینی اسهال آبکی، درد شدید شکم و درد شدید میشود و در نهایت منجر به مدفوع خونی موکوئیدی میشود که مشخصه اسهال باسیلی است. در صورت عدم وجود درمانهای موثر، بیماران شیگلوز ممکن است دچار عوارض ثانویه مانند سپتی سمی، ذاتالریه و سندروم اورمی همولیتیک شوند [ ۳ ].
شیگلوزیس در حدود ۱۶۴.۷ میلیون نفر در سال رخ میدهد که ۱.۱ میلیون مورد آن منجر به مرگ میشود. ۱۶۳.۲ میلیون مورد سالانه در کشورهای در حال توسعه رخ میدهد و ۶۹ % کل بیماران کودکان زیر پنج سال هستند.
شیگلا فلکسنری در بیشتر کشورهای در حال توسعه بومی است و باعث مرگ و میر بیشتری نسبت به هر گونه تلفات دیگر میشود. سروتایپ غالب شیگلا flexneri در کشورهای در حال توسعه سروتایپ های 1 b , 2 a , 3 a , 4 a و 6 هستند , در حالی که در کشورهای صنعتی بیشتر جدایه ها 2 a هستند . شیوع بالای شیگلا در کشورهای در حال توسعه به طور کلی به عدم وجود آب تمیز، بهداشت ضعیف، سو تغذیه و هزینه درمان آنتیبیوتیکی نسبت داده میشود. انتقال معمولا از طریق مدفوع صورت میگیرد که با بهداشت ضعیف و تماس شخصی نزدیک تقویت میشود.
آنتیبیوتیکها میتوانند برای درمان شیگلوزیس به کار روند و دوره دفع باکتری از بیمار را کاهش دهند. با این حال، شیگلا فلکسنری به طور فزایندهای در حال توسعه مقاومت آنتیبیوتیکی است [ ۶ ]. این افزایش مقاومت در برابر آنتیبیوتیکهای رایج و ارزانتر باعث افزایش فشار بر خدمات بهداشتی محدود کشورهای در حال توسعه میشود.
در نتیجه، سازمان بهداشت جهانی توسعه یک واکسن ایمن و موثر علیه شیگلا فلکسنری را در اولویت قرار دادهاست [ ۴ ].
ژنهای حدت متعددی در flexneri شناسایی شدهاند که اکثریت این ژنها بر روی پلاسمید a۲۲۰ kb قرار دارند که به عنوان پلاسمید حدت شناخته میشوند. حداقل سه جزیره بیماریزایی نیز بر روی کروموزوم شیگلا flexneri قرار گرفتهاند که فاکتورهای ویرولانس مهمی مانند لیپوپلی ساکارید و ژنها را برای تنظیم وابسته به دما بیان ژنهای ویرولانس بر روی پلاسمید رمزگذاری میکنند [ 7 - 10 ] . اخیرا دو توالی ژنوم شیگلا flexneri 2 a که شامل یک کروموزوم با حدود 4000 و 221 پلاسمید حدت 618 bp است ,شناسایی شدهاند [ 1 , 2 ] . این توالیها تایید کردهاند که شیگلا فلکسنری شامل تعدادی از ژنهای وابسته به باکتریوفاژ است. برخی از بهترین ویژگیهای ژنهای فاژ شیگلا flexneri ژنهای تغییر سروتایپ هستند که مسئول تغییرات فضایی سروتایپ در ساختار اصلی آنتیژن O هستند [ 11 ] .
نقش بسیاری از ژنهای ویرولانس شیگلا فلکسنری در انواع آزمایشها کشت سلولی مانند سنجش تهاجم و سنجش پلاک یا با استفاده از مدلهای حیوانی in vivo مانند تست Sereny در خوکچه هندی، مدل ریوی موش و روده مسدود شده خرگوش مورد مطالعه قرار گرفتهاست.
تحقیقات مستمر در مورد ویرولانس و پاتوژنز شیگلا فلکسنری درک بیشتری از اساس مولکولی تهاجم و تخریب مخاط روده و همچنین نقش میزبان در پاسخهای ایمنی ذاتی، سلولی و هومورال متعاقب آن به دست میدهد. درک کاملی از مکانیسمهای ایجاد کننده بیماری شیگلا فلکسنری به توسعه واکسن کمک خواهد کرد.
۲.پاتوژنز شیگلا فلکسنری
شیگللا فلکسنری به شدت عفونی است و نیازمند این است که با 100 باکتری در داوطلبان بالغ بیماری ایجاد کنند.
این دوز عفونی کم تا حدی به توانایی شیگلا فلکسنری در زنده ماندن از اسیدیته کم معده میزبان از طریق افزایش تنظیم در ژنهای مقاومت به اسید نسبت داده میشود.
زمانی که شیگلا به کولون میرسد، آنها شروع به حمله به مخاط میکنند، نفوذ میکنند، در داخل تکثیر میشوند و بین سلولهای اپیتلیال مخاطی پخش میشوند. این رفتار و پاسخ التهابی متعاقب میزبان، لایه اپی تلیال روده را تخریب میکند که علائم بالینی شیگلوزیس را ایجاد میکند (شکل ۱)[ ۱۸ ].
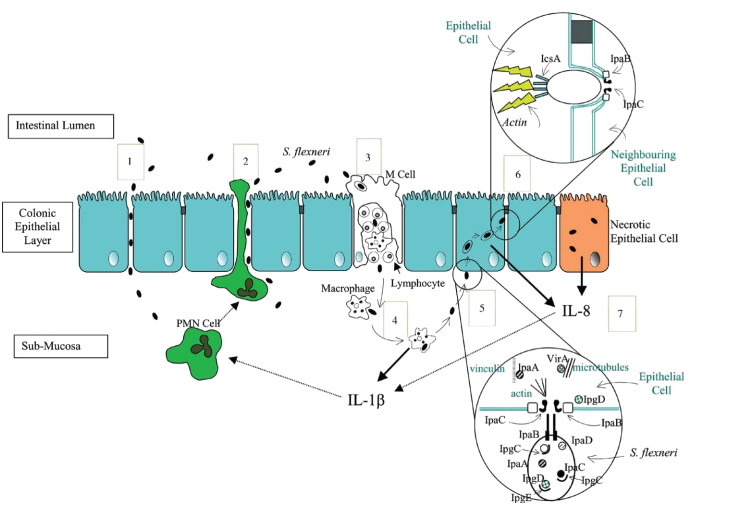
شکل ۱) پاتوژنز شیگلا فلکسنری ۱. باکتریهای لومن بوسیله سه مکانیزم شناختهشده به لایه اپیتلیال کولون حمله میکنند. شیگللا فلکسنری میتواند پروتئینهای با اتصال محکم بیانشده توسط سلولهای اپیتلیال را دستکاری کند و حرکت پارسلولار باکتریها را به زیر مخاط ممکن سازد. ۲. سلولهای PMN جذبشده توسط IL - ۸ و IL - ۱ b تولید شده در پاسخ به تهاجم شیگلا فلکسنری، شکافی بین سلولهای اپی تلیال ایجاد میکنند، که از طریق آن شیگلا فلکسنری میتواند به زیر مخاط مهاجرت کند. ۳. سلولهای آندوکیتیک M باکتریها را منتقل میکنند، و آنها را در جیب داخل اپی تلیال پر شده با لنفوسیتها و ماکروفاژهای B و T آزاد میکنند. ۴. ماکروفاژها باکتریها را از بین میبرند. شیگلا فلکسنری از فاگوزوم فرار میکند و ماکروفاژها را تحریک میکند تا آپوپتوز را تحمل کنند. ماکروفاژ آپوپتوز، IL - ۱ b را آزاد میکند. شیگللا فلکسنری زیر مخاطی با غشا پایه سلولهای اپی تلیال تماس دارد و ترشح پروتئینها را از طریق سیستم ترشح نوع ۳ فعال میکند. پروتئینهای چاپرون شده در سیتوزول شیگلا فلکسنری از طریق یک منفذ تشکیلشده توسط IpaB و IpaC، به سیتوپلاسم سلولهای اپیتلیال ترشح میشوند. IpaC اکتین را پلیمریزه میکند، IpgD غشای پلاسما را از اسکلت سلولی اکتین جدا میکند، VirA میکروتوبول ها را ناپایدار میکند و IpaA یک کمپلکس با vinculin و اکتین پلیمریزه کننده را شکل میدهد. این کار گسترش سطح سلولی را ایجاد میکند که در اطراف باکتری شکل میگیرد و سلول اپی تلیال را تحریک میکند تا شیگلا فلکسنری را به داخل یک واکوئل ببرد. 6) IpaB و IpaC واکوئل را احاطه میکنند و شیگلا flexneri را به سیتوپلاسم سلول اپی تلیال آزاد میکنند . پروتئین شیگلا flexneri , ICSA تنها روی یک قطب باکتری نمایش داده میشود و یک دم اکتین پلیمریزه شده پشت باکتری ایجاد میکند . این باعث میشود شیگلا از طریق سیتوپلاسم خم شود تا زمانی که با غشا پلاسما تماس پیدا کند، نیروی تماس یک برآمدگی به سلول اپی تلیال مجاور ایجاد میکند. هر دو غشا توسط IpaB و IpaC احاطه شدهاند و خمشی را به سلول اپی تلیال مجاور آزاد میکنند. ۷)شیگلا فلکسنری درون سلولی، سلول اپی تلیال را تحریک میکند تا IL - ۸ را آزاد کند. . IL - ۸ و IL - ۱ b آزاد شده از ماکروفاژهای apopotic، کموتاکتیک به سلولهای PMN هستند (با فلشهای نقطهچین نشان داده میشوند)، و آنها را به مهاجرت از لایه اپی تلیال به لومن جذب و القا میکنند. این اختلال اپی تلیال حمله شیگلا فلکسنری به لایه اپی تلیال را تقویت میکند.
۲.۱ عبور از لایه اپی تلیال کولون
آزمایشها با استفاده از ردههای سلولی قطبی نشان دادهاند که اکثر تهاجم سلولهای اپی تلیال شیگلا فلکسنری از طریق قطب قاعدهای جانبی سلولهای اپی تلیال روده رخ میدهد [ ۱۹ ]. لایه اپیتلیال به عنوان مانعی بر سر راه پاتوژن های موجود در لومن روده عمل میکند. شیگلا فلکسنری قادر به نفوذ به پوشش اپی تلیال از طریق اپیتلیوم مرتبط با فولیکول است (FAE). این لایه اپیتلیال است که در بالای غدد لنفاوی مرتبط با مخاط یافت میشود که شامل سلولهای بسیار اندوکریتیک M است (سلولهای اپیتلیال غشایی).
سلولهای M آنتیژن لومن را از طریق مانع اپی تلیال نمونهبرداری میکنند و آن را به جیب داخل اپی تلیال که توسط غشای قاعدهای - جانبی سلول M شکل میگیرد، آزاد میکنند. این جیب با لنفوسیتها و ماکروفاژها که منتظر دریافت هر گونه آنتیژن لومن تحویل دادهشده هستند و یک پاسخ ایمنی مخاطی را آغاز میکنند، پر شدهاست [ ۲۰ ]. خواص تراسیتوتیک سلولهای M به عنوان مسیری برای تهاجم پوشش اپی تلیال نفوذناپذیر توسط تعدادی از عوامل بیماری زا، از جمله شیگلا فلکسنری (شکل ۱)مورد استفاده قرار میگیرد [ ۱۵ ].
به نظر میرسد که شیگللا از طریق همان غشا که در تهاجم سلول اپی تلیال دیده میشود، وارد سلولهای M میشود [ ۲۱ ]. زمانی که شیگا در یک واکوئل اندوکریتیک توسط سلول M درونی شد، به سرعت از طریق سلول حرکت میکند و به جیب داخل اپی تلیال آزاد میشود. وقتی FAE عبور کرد، شیگلا میتواند به غشا پایه - جانبی سلولهای اپی تلیال دسترسی داشته باشد.
در مراحل بعدی عفونت شیگلا، شیگا از پاسخ التهابی میزبان به منظور تقویت نفوذ باکتریایی اپیتلیوم روده استفاده میکند.
ماکروفاژهای عفونی شده با شیگلا فلکسنری، القا میشوند تا آپوپتوز را تحمل کنند و مقادیر زیادی از IL - ۱ را آزاد میکنند، که در القای التهاب و تغییر مسیر سلولهای PMN به محل عفونت مهم است. علاوه بر این، تهاجم سلولهای اپی تلیال توسط شیگلا، رونویسی و ترشح IL - ۸ را فعال میکند.
IL - ۸ کموتاکسیک برای سلولهای PMN است و نقش مهمی در جذب سلولهای PMN به ناحیه زیر اپی تلیال عفونی بازی میکند، که در آن از پوشش اپی تلیال برای رسیدن به باکتریهای لومن شکل ۱ عبور میکنند.
هجوم سلولهای PMN در سراسر لایه اپی تلیال در پاسخ شیگلا، یکپارچگی سلولهای اپی تلیال را مختل میکند و به باکتریها اجازه میدهد تا در یک مکانیزم مستقل از سلول M، وارد زیر مخاط شوند [ ۲۳ ]. اثبات شدهاست که بکارگیری این PMN برای ایجاد التهاب و تخریب بافت نوعی شیگلوزیس در تعدادی از مطالعات ضروری است. آزمایشها در مدل حلقه روده خونی خرگوش عفونت شیگالا که در آن یا IL - ۱ و یا IL - ۸ تقریبا التهاب، تخریب بافت را مهار میکند و به طور قابلتوجهی میزان تهاجم باکتری را کاهش میدهد.
علاوه بر این، مسدود کردن CD۱۸، یک مولکول چسبنده مورد استفاده توسط PMN ها در طول مهاجرت، در همان مدل حیوانی نیز آسیب بافتی و تهاجم باکتریایی را کاهش میدهد [ ۲۶ ].
از قضا، قطع نقش مانع لایه اپیتلیال توسط PMN، گسترش محلی شیگلا را ارتقا میدهد، در حالی که به نظر میرسد همان سلولهای PMN مسئول محدود کردن عفونت به ساب موسوکوزا و جلوگیری از انتشار سیستمیک هستند [ ۲۵ ].
تحقیقات اخیر نشان دادهاست که شیگلا فلکسنری قادر به دستکاری پروتئینهای مرتبط با اتصال محکم سلولهای اپیتلیال روده انسان است که اجازه حرکت پاراسلولار باکتریایی را از طریق یک مدل مانع درون رودهای میدهد. این نتایج نشان میدهد که شیگا همچنین قادر به نفوذ به اپیتلیوم کولون از طریق یک سلول M یا مکانیزم مستقل PMN است (شکل ۱)[ ۲۷ ].
۲.۲. آپوپتوز ماکروفاژ
به محض آزاد شدن در جیب داخل اپی تلیال سلول M، باکتریها توسط ماکروفاژهای ساکن احاطه میشوند، احتمالا از طریق یک واقعه ماکروپینوستیک محرک باکتریایی شبیه به ورود شیگلا از سلولهای اپی تلیال. شیگلا فلکسنری قادر به فرار از مکانیسمهای کشتن ماکروفاژها توسط IpaB به واسطه لیز کردن واکوئل فاگوسیتی است (شکل ۱). خواص هیدرولیز کننده غشا پلاسمید ویرولانس IpaB به باکتریها این امکان را میدهد که دسترسی آزاد به سیتوپلاسم داشته باشند. هنگامی که در سیتوزول ماکروفاژ، IpaB ترشح میشود، کاسپا ز -۱ را متصل و فعال میکند که عضوی از سیستئین پروتئاز موافق با خزان است [ ۳۰ ]. آپوپتوزیس وابسته به کاسپا ز -۱ یک مرگ سلولی خاموش از نظر ایمنی نیست، زیرا کاسپا ز -۱ فعال میشود و سیتوکینهای پیشبرنده التهاب IL - ۱ b و IL - ۱۸ را فعال میکند. آپوپتوز ماکروفاژ در عرض چهار ساعت از عفونت شیگلا در بدن رخ میدهد و باکتریها را در زیر مخاط آزاد میکند.
۳. ۳ اتصال به غشای قاعدهای - جانبی سلولهای اپی تلیال کولون هنوز دقیقا مشخص نیست که چرا شیگللا فلکسنری ترجیحا به سلولهای اپی تلیال از طریق غشای قاعدهای - جانبی آنها حمله میکند. غشا راسی سلولهای اپی تلیال کولون با گلیکولیپیدها پوشیده میشود که یک لایه مخاطی را تشکیل میدهند. این لایه ممکن است به عنوان یک مانع فیزیکی که مانع از دسترسی شیگلا فلکسنری به غشای اپیکالی میشود عمل کند و با سیستمهای ترشح نوع ۳ که آنتی ژنهای پلاسمید تهاجمی (Ipa)را منتقل میکنند، که برای ورود شیگللا به سلولهای اپیتلیال مورد نیاز است، تداخل کند [ ۳۳ ].
علاوه بر این، غشا پایه - جانبی سلولهای اپی تلیال ممکن است اجزای سلولی مورد استفاده توسط شیگلا را به عنوان گیرندههای چسبندگی سلولی نشان دهد. نقش اتصال سلول اپی تلیال با واسطه گیرنده در عفونت شیگلا به خوبی درک نشده است. با این حال , مشخص شدهاست که سیستم ترشحی شیگلا Mxi / Spa نیاز به تماس با یک سلول میزبان دارد تا ترشح Ipa را تحریک کند . تعدادی از گیرندههای قاعدهای - جانبی که قادر به اتصال اجزای شیگلا هستند، شناسایی شدهاند. پروتئینهای Ipa قادر به تعامل با اینتگرین a۵b۱ هستند که یک گیرنده قاعدهای - جانبی است که ماتریکس خارج سلولی واقع در آن را متصل میکند.
IpaB همچنین قادر به اتصال گیرنده غشایی CD۴۴ است که گیرنده سطحی سلول اصلی برای اسید هیالورونیک است و در غشای بازو جانبی سلولهای اپی تلیال یافت میشود. هر دو اینتگرین a۵b۱ و CD۴۴ میتوانند به عنوان لینکر اسکلت سلولی عمل کنند، به طوری که با اتصال شیگلا ممکن است به سازماندهی مجدد اسکلت سلولی دیدهشده در طول تهاجم اپیتلیال احترام بگذارند [ ۳۸ ].
اخیرا نشانداده شدهاست که چسبندگی باکتریایی به سلولهای اپی تلیال در یک بافت پوششی مدل پولاریزه به طول و حضور آنتیژن O بستگی دارد [ ۳۹ ]. این نتایج نشان میدهد که شیگلا flexneri ال پی اس ممکن است نقش مهمی در میانکنش باکتریها در طول تهاجم سلولهای اپی تلیال ایفا کند . تعدادی از گیرندههای سلولی که قادر به اتصال LPS هستند، از جمله CD۱۴ و خانواده تولل از گیرندهها (TLRs)، که در غشا پایه - جانبی سلولهای اپی تلیال یافت میشوند، مشخص شدهاند [ ۴۰، ۴۱ ].
۲.۴ به جذب توسط سلول اپی تلیال
شیگللا فلکسنری از طریق یک فرآیند ماکروپینوستیک به سلولهای اپیتلیال تهاجم میکند، که در آن بازآرایی اسکلت سلولی سلول میزبان القا شده توسط فلنسری باکتری را در یک واکوئل غوطهور میکند (شکل ۱). پلاسمید ویرولانس شیگلا flexneri دو مکان ژنی مهم برای این فنوتیپ تهاجمی , مکان ژنی ipa و مکان ژنی mxi - spa را کد میکند . اپرون ipa، "آنتی ژنهای پلاسمید تهاجمی"، IpaA، IpaB، IpaC و IpaD را کد میکند که عوامل ورودی باکتری به سلول میزبان هستند. اپرون mxispa اجزای یک سیستم ترشح نوع III را کد میکند، که یک ساختار فلاژل مانند است که برای انتقال پروتئینهایی مانند پروتئینهای Ipa، از سیتوپلاسم باکتری تا غشای سیتوپلاسمی و یا حتی سیتوزول سلول میزبان استفاده میشود [ ۴۲ ]. اپرون mxi - spa و IpaB، IpaC و IpaD برای تهاجم سلولهای اپی تلیال در شرایط آزمایشگاهی ضروری هستند [ ۴۳، ۴۴ ].
مکانیزمهای دقیقی که توسط آنها پروتئینهای Ipa تهاجم شیگلا را تولید میکنند به طور کامل متوقف نشده اند. پروتئینهای Ipa سنتز شده و درون باکتری ذخیره میشوند، که در آن با پروتئینهای چاپرونی تا زمانی که ترشح با یک سلول میزبان فعال شود، در ارتباط هستند. یک مجموعه تشکیلشده توسط IpaB و IpaD ممکن است در تنظیم این خود - مهاری نقش داشته باشد [ ۳۴ ]. هنگامی که ترشح با تماس با سلول اپی تلیال فعال میشود، N - ترمینال IpaC به IpaB متصل میشود.
هر دو پروتئین آبگریز هستند که اجازه میدهند این کمپلکس به غشا سلول میزبان وارد شود تا یک منفذ را تشکیل دهد [ ۴۸ ]. فرض بر این است که دیگر ذرات کروی که توسط نوع ۳ ترشح میشوند، قادر به دستکاری سیتوپلاسم میزبان از طریق این حفره هستند.
دامنه C - ترمینال IpaC، سلول میزبان Rho GTPase را فعال میکند، پلیمریزه کردن اکتین و گسترش fi-lopodial در مجاورت باکتری را تحریک میکند [ ۴۹ ].IpaA به سیتوزول سلول اپیتلیال میزبان ترشح میشود که در آن به vinculin پروتئین مرتبط با اسکلت سلولی متصل میشود. کمپلکس ایپا وینکلر رشتههای اکتین را دپلیمریزه میکند و یک کانون توجه را در اطراف باکتری سازماندهی میکند [ ۵۰، ۵۱ ].IpgD توسط سیستم ترشح شیگللا فلکسنری نوع III به سلول اپیتلیال تزریق میشود، که در آن به عنوان فسفاتاز فسفو نوسیتاید عمل میکند و غشای پلاسما را از اسکلت سلولی اکتین جدا میکند و اجازه میدهد تا توسعه غشایی شکل بگیرد [ ۵۲ ].
VirA عنوان یک مولکول وکتور اضافی برای تهاجم سلولهای اپی تلیال شیگلا فلکسنری شناسایی شدهاست. تعامل بین VirA و توبولین در داخل میزبان سیتوزول میکروتوبول ها را در اطراف محل ورود باکتری ناپایدار میکند. پیشنهاد میشود که این ناپایداری میتواند باعث تحریک Rho، یک خانواده GTPase شود و بسطهای لامپیودیال را در سلول میزبان ایجاد کند [ ۵۳ ].
بازآرایی اسکلت سلولی القا شده توسط پروتئینهای effector شیگلا منجر به درونی شدن باکتری توسط سلول اپیتلیال در یک واکوئل ماکروپینوستیک میشود.
۲.۵. تکثیر در سلول اپی تلیال و گسترش داخل سلولی و بین سلولی واکوئل ماکروپینوستیک حاوی باکتری شیگلا به سرعت توسط IpaB تهاجم احاطه میشود که به عنوان سم ممبرکولیتیک در غشای فاگوزوم عمل میکند و شیگلا را به سیتوپلاسم سلول میزبان آزاد میکند.
لیز فاگوزوم نیز ممکن است شامل IpaC باشد، که قادر به مختل کردن غشاهای فسفولیپید پس از وارد کردن نواحی هیدروفوب آن است [ ۵۴، ۵۵ ].
شیگلا فلکسنری میتواند درون سیتوپلاسم سلولهای اپی تلیال در شرایط آزمایشگاهی با زمان دو برابر شدن ۴۰ دقیقه تکثیر شود. سلولهای اپی تلیال در طول شیگلوزیس تحت مرگ شبه نکروتیک مشاهده میشوند (شکل ۱)[ ۵۶ ]. اگر چه در ابتدا پیشنهاد شد که تکثیر شیگلا در سیتوزول علت لیز سلولهای اپی تلیال است، اما به نظر میرسد که این سلولها توسط پاسخ التهابی میزبانها در حال تخریب هستند.
در واقع، شیگلا مزیت کمی از کشتن سلول اپی تلیال به دست میآورد در حالی که باکتریها در داخل سلول اپی تلیال که آنها از سلولهای ایمنی محافظت میکنند قرار دارند و در محیط مطلوبی برای تکثیر هستند [ ۵۶ ].
mxiE، ژنی که در جایگاه mxi / spa قرار دارد، اخیرا به عنوان یک تنظیمکننده رونویسی برای تعدادی از فاکتورهای ویرولانس احتمالی مورد نیاز برای مقاومت در تست Sereny شناسایی شدهاست. mxiE تنها زمانی فعال میشود که باکتری در سیتوزول سلول اپی تلیال باشد که نقش آن تنظیم ژنهای ویرولانس مورد استفاده در مراحل پس از تهاجم عفونت باشد.
شیگلا قادر به بهرهبرداری از دستگاه مونتاژ اکتین سلولهای میزبان برای حرکت از طریق سیتوپلاسم سلول میزبان و به سلولهای اپی تلیال مجاور است. این گسترش درون و بین سلولی یک مرحله حیاتی در ویرولانس شیگلا است و توسط پروتئین غشای خارجی، IcsA (virus G)هدایت میشود [ ۵۸ - ۶۰ ].ICSA به روش تکقطبی بر روی سطح باکتری بیان میشود، با بیشترین غلظت متمرکز شده بر روی قطب قدیمی باکتری [ ۶۱ ]. به نظر میرسد که ICSA به تازگی سنتز شده به طور مستقیم توسط دو منطقه داخلی به قطب قدیمی هدف قرار میگیرد، که در آن به صورت خودکار به غشای خارجی منتقل میشود [ ۶۲، ۶۳ ]. حفظ موقعیت تکقطبی ICSA ها برای حرکت درون سلولی ضروری است و به نظر میرسد که به ساختار ال پی اس وابسته باشد . شیگلا فلکسنری موتان از دست رفته، بیان آنتیژن O جزئی s یا فقدان توزیع معین طول زنجیره آنتیژن O، موقعیت یابی سطح غیر قطبی ICSA را نشان میدهد و قادر به گسترش از سلول به سلول نیست [ ۶۴ - ۶۶ ]. این امکان وجود دارد که ال پی اس قطبیت ICSA را با تشکیل میکرودومن های بههمپیوسته با زنجیرههای جانبی O - آنتیژن خود بر روی سطح باکتری حفظ کند , که از جدا شدن ICSA از قطب قدیمی جلوگیری میکند [ 67 ] . یک مطالعه اخیر نشان دادهاست که شیگللا فلکسنری باید زنجیرههای آنتیژن O کوتاه را به منظور جلوگیری از مسدود شدن محلهای فعال ICSA توسط زنجیرههای آنتیژن O بلند نشان دهد. این یافته نشان میدهد که Shigella flexneri برای بیان دو طول زنجیره آنتیژن O با هر کدام که در ویرولانس این نژاد نقش دارند، تکاملیافته است. زنجیرههای کوتاهی که به ICSA اجازه میدهند تا عمل کند و زنجیرههای بلندی که مقاومت را به سرم اعطا میکنند.
همچنین به نظر میرسد که پروتئین DegP برای گسترش درون سلولی موثر و بیان قطبی ICSA مورد نیاز است. نقش دقیق DegP نامشخص است اما ممکن است در انتقال ICSA به سطح باکتری مهم باشد [ ۶۹ ].
ICSA در قطب باکتریایی با پروتئین عصبی میزبان یعنی پروتیین سندروم ویسکوت آلدریچ (N - WASP)و احتمالا vinculin برهمکنش میدهد. ICSA به طور خاص NWASP و نه دیگر اعضای خانواده WASP را متصل میکند، که پروتیین مربوط به اکتین (Arp)۲ / ۳ با واسطه کمپلکس اکتین پلیمریزه میشود [ ۷۳، ۷۴ ]. این ویژگی لیگاند IcsA N - WASP ممکن است تعیین کند که کدام سلولهای میزبان به Shigella اجازه میدهند تا از حرکت مبتنی بر اکتین استفاده کند [ ۷۴ ].
پلیمریزه شدن اکتین در قطب باکتری نیروی پیش رانی ایجاد میکند که باکتری را از طریق سیتوپلاسم سلول هدایت میکند تا زمانی که با غشای سلول میزبان تماس پیدا کند و یک برآمدگی به داخل سلول اپی تلیال مجاور ایجاد کند [ ۷۵ ]. این برآمدگی به طور فعال توسط سلول همسایه در یک مکانیزم وابسته به زنجیره سبک کیناز میوزین ایجاد میشود، که به بیان کادهرین نیز نیاز دارد [ ۷۶، ۷۷ ]. سپس باکتریها توسط دو غشا سلولی احاطه میشوند که توسط IpaB و IpaC ترشحشده احاطه شدهاند [ ۷۸ ]. یک پروتئین دیگر VacJ نیز نشانداده شدهاست که برای آزاد کردن شیگلا به داخل سیتوپلاسم سلول بعدی ضروری است [ ۷۹ ]. بنابراین، شیگلا قادر به تکثیر و گسترش در لایه اپیتلیال روده است در حالی که از قرار گرفتن در معرض محیط خارج سلولی و سلولهای ایمنی در گردش آن اجتناب میکند.
۳. پاسخ ایمنی میزبان به فلکسنری
۳.۱ ایمنی ذاتی
برچسب های مهم