
امروز جمعه ۲۱ اردیبهشت ۱۴۰۳
دسته بندی سایت
برچسب های مهم
پیوند ها
آمار بازدید سایت
اصطلاح فارماکوکینتیک آنتیبیوتیک به این اشاره دارد که چگونه (و تا چه حدی)آنتیبیوتیکها وارد بدن میشوند، زمانی که "داخل" هستند کجا میروند، و چگونه خارج میشوند. این سه مرحله فارماکوکینتیک معمولا به صورت جذب، توزیع و متابولیسم / ترشح (گاهی اوقات به اختصار ADME)توصیف میشوند. فارماکوکینتیک آنتیبیوتیکها کلید موثر بودن داروها در عمل بالینی هستند؛ هیچ فایدهای برای بیمار وجود ندارد که آنتیبیوتیک دریافت کند که در صورت عدم دسترسی به محل عفونت در غلظتهای بالا، منجر به مرگ و میر ناشی از آن شود. اگر در مورد آن فکر کنید، این یک مساله برای بیشتر بیماریهای انسانی است، اما در بیماریهای عفونی از نظر بالینی بسیار مرتبط است. لازم نیست تعجب کنید که phenytoin به سیستم عصبی مرکزی (CNS)توزیع میشود یا خیر. با این حال، مهم است بدانید که سفتریاکسون در آنجا به خوبی توزیع میشود اما سفازولین در صورتی که شما مننژیت را درمان میکنید، توزیع نمیشود. شکل ۱ - ۳ فازهای ADME را در یک منحنی زمان - غلظت، با غلظت دارو بر روی محور Y و زمان از زمان توزیع دارو بر روی محور X نشان میدهد. همچنین پارامترهای کلیدی فارماکوکینتیک غلظت اوج، غلظت و سطح زیر منحنی غلظت - زمان (AUC)را نشان میدهد.
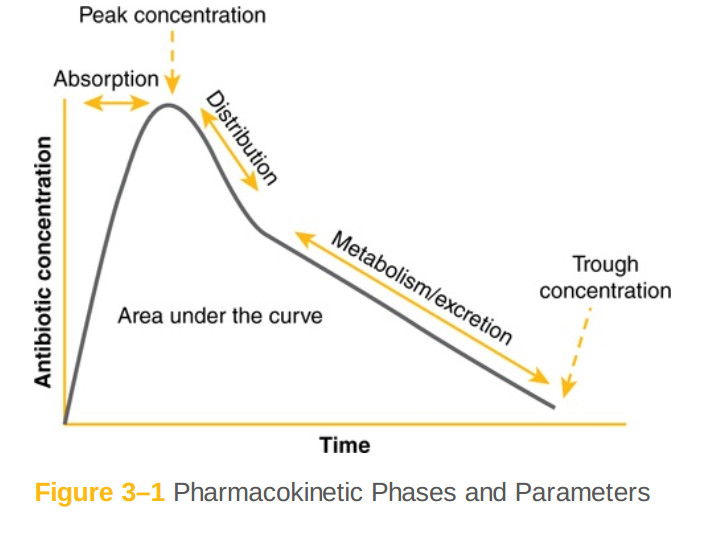
شکل ۱ - ۳ فارماکوکینتیکی و پارامترها
جذب
اگر چه اصطلاح "جذب" را می توان در هر روش تجویز به کار برد (به عنوان مثال، جذب از تزریق عضلانی یا تنفس)، معمولا برای اشاره به جذب داروهای خوراکی به درون جریان خون استفاده میشود. درصد داروی غیر تزریقی که وارد جریان خون میشود (مانند داروی خوراکی)، نسبت به یک فرمولاسیون وریدی از همان دارو، زیست فراهمی نامیده میشود. آنتیبیوتیکها با فرمولاسیون های خوراکی در زیست فراهمی آنها تفاوت قابلتوجهی دارند. برای برخی از آنتیبیوتیکها، زیست فراهمی در حدود ۱۰۰ درصد است. تجویز همان دوز به صورت خوراکی یا داخل وریدی به مقادیر مشابهی منجر خواهد شد. لازم به ذکر است که چندین آنتیبیوتیک زیست فراهمی بسیار خوبی دارند، اما دوز خوراکی آنها به طور قابلتوجهی کمتر از دوز تزریقی است. این امر معمولا به این دلیل است که دوزهای بالای خوراکی منجر به مسمومیت بیش از حد دستگاه گوارش (GI)میشود.
جدول ۱ - ۳ آنتیبیوتیکها را در گروههایی با زیست فراهمی بالا و معادل دوز خوراکی کامل یا نزدیک وریدی، آنهایی که زیست فراهمی خوراکی خوبی دارند اما به طور قابلتوجهی کمتر از دوز تزریقی هستند و آنهایی که زیست فراهمی خوراکی محدودی دارند، قرار میدهد. برخی از آنتیبیوتیکهای خوراکی دسترسی زیستی تقریبا صفر دارند و از این مزیت بالینی برای از بین بردن پاتوژن ها در دستگاه گوارش استفاده میکنند، که در آن غلظت بسیار بالاتری نسبت به حالتی که به صورت وریدی تجویز میشود، به دست میآورند.
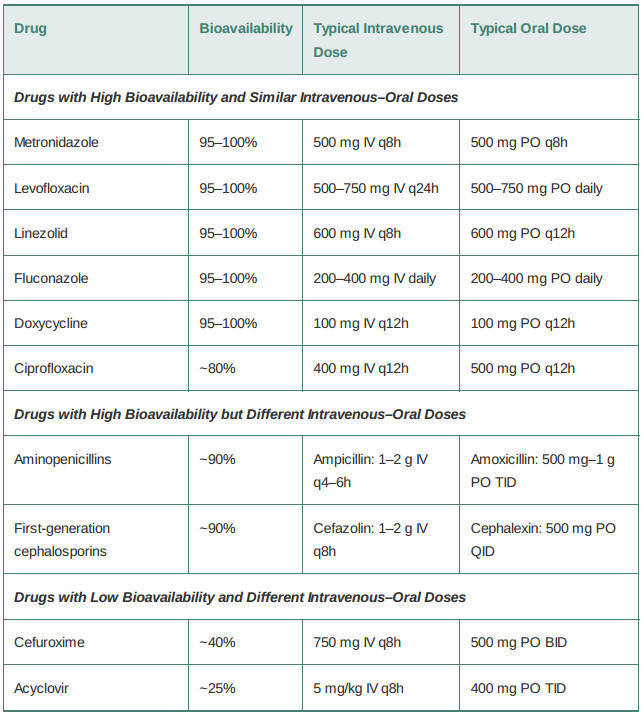
جدول ۳ - ۱: مثالهایی از جذب برای آنتی بیوتیک های مختلف خوراکی
مهم است که عواملی را در نظر بگیریم که میتوانند بر زیست فراهمی آنتیبیوتیکها تاثیر بگذارند. سه عاملی که میتوانند جذب را به طور قابلملاحظهای تحتتاثیر قرار دهند عبارتند از: مواد غذایی، اسیدیته معده و عوامل chelating. برخی از آنتیبیوتیکها بهتر با غذا جذب میشوند و برخی دیگر بدون آن، در حالی که برای بیشتر آنتیبیوتیکها حضور یا عدم حضور غذا کمترین اثر را دارد.
گروه کوچکی از آنتیبیوتیکها برای جذب کافی به شدت به اسیدیته معده وابسته هستند. در صورت شروع درمان با داروهای مهار کننده پمپ پروتون و آنتاگونیست های گیرنده هیستامین - ۲، لازم است از مصرف همزمان داروهایی که باعث افزایش pH معده میشوند (آنتی اسیدها، مهارکنندههای پمپ پروتون و آنتاگونیست های گیرنده هیستامین - ۲)اجتناب شود. در نهایت، دو گروه کلیدی از آنتیبیوتیکها - تتراسایکلینها و فلوروکینولون ها - میتوانند به مواد معدنی موجود در روده مانند کلسیم، آهن، آلومینیوم و روی متصل شوند. استفاده از این داروها به همراه مواد معدنی و یا برخی مکملهای ویتامینی میتواند به طور قابلتوجهی جذب را کاهش دهد. جدول ۲ - ۳ مثالهایی از آنتیبیوتیکها را نشان میدهد که در آن این عوامل باید در نظر گرفته شوند.
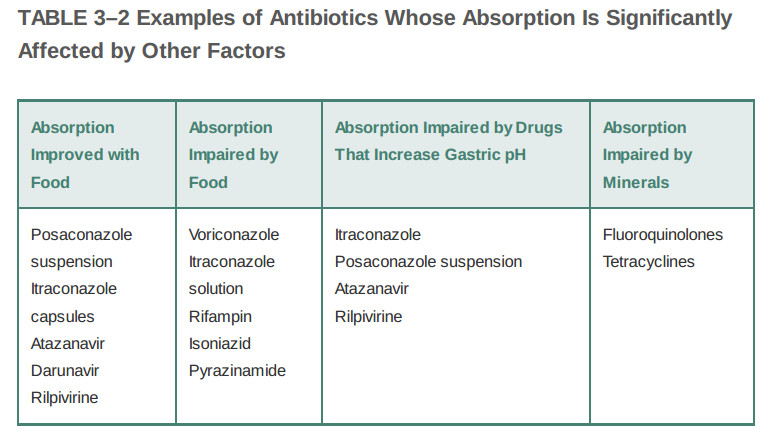
جدول ۳ - ۲: مثالهایی از جذب آنتیبیوتیکها که به طور قابلتوجهی تحتتاثیر عوامل دیگر قرار میگیرد
توزیع : بعد از اینکه یک دارو جذب یا به جریان خون تزریق میشود، به بافتهای مختلف (به عنوان مثال، استخوان، مایع مغزی نخاعی، ریهها)حرکت میکند، فرایندی که به عنوان توزیع شناخته میشود. غلظت در این بافتها میتواند مشابه، کمتر یا بیشتر از غلظت آنتیبیوتیک در خون باشد. نتیجه این است که یک دارو ممکن است در یک بافت خاص بیشتر یا کمتر از آنچه انتظار میرود براساس غلظت آن در خون، موثر باشد. برای مثال، غلظت آنتیبیوتیکها در مایع مغزی - نخاعی معمولا بسیار کمتر از غلظت جریان خون آنها است، که اثربخشی بسیاری از آنتیبیوتیکها را در درمان مننژیت محدود میکند. از سوی دیگر، آنتیبیوتیکهای ماکرولید در عفونتهای ریوی موثرتر از آن چیزی هستند که ممکن است براساس سطح خون آنها پیشبینی شود، زیرا آنها در ماکروفاژهای ریوی تمرکز میکنند. با چند استثنا مانند مایع مغزی - نخاعی، به دست آوردن نمونههایی از بافتهای انسان برای تعیین غلظت آنتیبیوتیک دشوار است و از نظر تکنیکی اندازهگیری غلظت در بافتهایی مانند استخوان دشوار است. بنابراین، دادههای توزیع دارو اغلب از مدلهای حیوانی برون یابی میشوند که ممکن است جایگزینهای خوبی برای انسان باشند یا نباشند.
میزان توزیع آنتیبیوتیکها در بافتهای مختلف تا حد زیادی توسط ویژگیهای فیزیکوشیمیایی دارو (لیپوفیلیک بودن، بار، اندازه مولکولی و غیره)تعیین میشود. یک عامل تعیینکننده کلیدی در توزیع میزان اتصال آنتیبیوتیک به پروتئین در جریان خون است، از همه مهمتر آلبومین (شما ممکن است این را به عنوان “fraction bound” یا “fraction unbound بشنوید). داروی متصل به پروتئینها قادر به پخش در سراسر غشا به بافتهای مختلف نیست. از این رو، احتمال دسترسی به غلظت موثر آنتیبیوتیکها در برخی از بافتها (مانند CNS)کمتر است. درک این نکته مهم است که درصد نفوذ آنتیبیوتیک در بافت تنها تعیینکننده اثربخشی آن بافت نیست. برای مثال، سفتریاکسون یک داروی بسیار متصل به پروتئین است و ۵ % یا کمتر در بیماران مبتلا به مننژیت وارد سیستم عصبی مرکزی میشود. با این حال، دوزهای زیاد (۲ گرم در روز در بزرگسالان)سفتریاکسون را می توان به طور ایمن به بزرگسالان داد، که منجر به سطوح بالای سرمی میشود (مقادیر اوج در حدود ۲۰۰ mg / L). به علاوه، حداقل غلظت بازدارنده (MIC)سفتریاکسون برای ارگانیسمهایی که معمولا باعث مننژیت میشوند، معمولا بسیار پایین است (۱ mg / L یا کمتر)؛ بنابراین می توان غلظت فراتر از MIC ارگانیسم را بدست آورد (۲۰۰ mg / L * ۵ % = ۱۰ mg / L). همچنین منحنیهای غلظت - زمان در بسیاری از بافتها متفاوت از آنها در جریان خون هستند - بیشتر شبیه تپههای غلتان هستند تا قلهها و درهها (فکر کنید Appalachians در مقابل Rockies ها).
ویژگیهای بیمار نیز ممکن است به طور قابلتوجهی بر توزیع دارو تاثیر بگذارد. برای اینکه یک دارو به بافت توزیع شود، باید جریان خون کافی به آن بافت وجود داشته باشد. شرایطی که جریان خون به بافتها را، چه به صورت محلی (به عنوان مثال، بیماری عروق محیطی)و چه به صورت سیستمیک (شوک سپتیک)کاهش میدهند، میتوانند غلظت آنتیبیوتیک را در محل عفونت کاهش دهند. بیماران مبتلا به عفونتهای شدید میتوانند آبسهها یا نواحی مرده و بافتهای بلعیده شده را توسعه دهند. توزیع آنتیبیوتیکها در این مناطق "حفاظتشده" میتواند به طور قابلتوجهی دچار اختلال گردد. این بیماران تنظیمات کاملی برای شکست درمان و گسترش مقاومت هستند و اهمیت مدیریت مناسب جراحی عفونتها همراه با درمان آنتیبیوتیکی را برجسته میکنند. با توجه به مشکل رو به رشد چاقی، یکی دیگر از ملاحظات مهم این است که داروها تا چه حد در بافت چربی توزیع میشوند. بسته به ویژگیهای دارو، ممکن است بیماران چاق بدحال را کمتر از حد مجاز دارو مصرف کنند (اگر دارو به طور گسترده در بافت چربی توزیع شود و دوز برای وزنهای استاندارد استفاده شود)یا آنها را بیش از حد مجاز دارو مصرف کند (اگر به دلیل چاقی دوز بالاتری استفاده شود، اما دارو به خوبی در بافت چربی بیش از حد توزیع نشود). بنابراین، ممکن است توصیههایی برای مصرف آنتیبیوتیک براساس وزن کل یا واقعی بدن، وزن ایدهآل بدن (برآوردی از وزن بدن بیمار بدون بافت چربی اضافی)، یا وزن بدن تعدیلشده (مقداری بین وزن ایدهآل و وزن کل بدن)ببینید. این منطقهای است که نسبتا کمتر مورد مطالعه قرار گرفتهاست.
در نهایت، لازم به ذکر است که به جز چند مورد استثنا، تست حساسیت میکروبی، توزیع را در نظر نمیگیرد و براساس غلظتهای قابل حصول جریان خون است. برای مثال، آزمایشگاه میکروبیولوژی ممکن است تعیین کند که یک ارگانیسم با MIC ۴ mg / L نسبت به دارویی که به غلظت ۸ mg / L در جریان خون دست مییابد حساس است، اما ممکن است تنها به غلظت ۱ mg / L در مایع مغزی نخاعی دست یابد. بنابراین، آن دارو احتمالا برای عفونت جریان خون ناشی از ارگانیسم عمل میکند، اما در مننژیت که غلظت مایع مغزی نخاعی مهم است، شکست میخورد. بنابراین، توزیع یک ملاحظه کلیدی در هنگام انتخاب آنتیبیوتیکها است.
متابولیسم / بسط
بسیاری از آنتیبیوتیکها از بدن، چه در ادرار و چه در مدفوع، به همان شکلی که تجویز میشوند، دفع میشوند. در واقع، مدت کوتاهی پس از توسعه پنیسیلین و کمیاب بودن تجهیزات، پزشکان برای جمعآوری ادرار بیمارانی که پنیسیلین و تبلور مجدد دارو را برای استفاده در بیماران دیگر دریافت کردند، استفاده کردند! هنگامی که یک دارو بدون تغییر دفع میشود، میتواند به غلظتهای بسیار بالایی در منطقهای که در آن حذف میشود برسد، و آن را به طور بالقوه برای عفونت در آن سیستمها موثرتر از آنچه که براساس غلظت خون پیشبینی میشود، میکند. به عنوان مثال، غلظتهای نیتروفورانتوئین بهدستآمده در خون و بافتها به طور کلی برای مهار رشد باکتری ناکافی هستند. با این حال، آن توسط کلیهها از جریان خون حذف میشود و در مثانه جمع میشود تا وقتی که پاک شود. غلظتهای بهدستآمده در مثانه چند برابر بیشتر از غلظتهای موجود در جریان خون است که نیتروفورانتوئین را به یک داروی موثر برای درمان عفونتهای مثانه تبدیل میکند.
هنگامی که بدن دارو را غیر فعال نمیکند، یک ملاحظه مهم این است که اگر آسیبی به عضو مسئول دفع دارو وارد شود، به طور مناسب دوز تجویز شده دارو را کاهش دهد. رایجترین مثال برای آنتیبیوتیکها، نیاز به کاهش دوز بیشتر بتالاکتام ها برای بیماران مبتلا به اختلال عملکرد کلیه است تا از تجمع سطوح سمی دارو جلوگیری شود. همچنین پزشکان باید نسبت به افزایش دوز هوشیار باشند اگر بیماران بهبود عملکرد کلیه یا عدم درمان ممکن است رخ دهد.
داروهای دیگر ممکن است به طور گسترده توسط بدن قبل از دفع آنها تبدیل شوند. این آنتیبیوتیکها که تحت متابولیسم گسترده قرار میگیرند، به عنوان سوبستراهای آنزیمهای متابولیزه کننده دارو در نظر گرفته میشوند. آنها پتانسیل این را دارند که در معرض فعل و انفعالات دارویی مهم بالینی قرار گیرند، چون داروهای دیگر ممکن است با آنزیمهایی که داروها را تجزیه میکنند تداخل داشته باشند. علاوه بر این، آنتیبیوتیکهای خاص این پتانسیل را دارند که متابولیسم داروهای دیگر را تحتتاثیر قرار دهند، یا از طریق مهار آن آنزیمها (که منجر به کاهش متابولیسم داروی دیگر میشود)و یا القا (که منجر به افزایش متابولیسم داروی دیگر میشود). فهرستی از آنتیبیوتیکها با بیشترین احتمال فعل و انفعالات دارویی متابولیک از نظر بالینی قابلتوجه در جدول ۳ - ۳ نشانداده شدهاست، که توسط این که آیا دارو یک سوبسترا، یک بازدارنده، یا یک القاکننده است یا خیر (و توجه داشته باشید که داروها ممکن است در بیش از یک دسته باشند)سازماندهی شدهاست. توجه داشته باشید که چندین کلاس آنتیبیوتیک به طور خاص شایع هستند: ماکرولیدها، داروهای ضد قارچ آزول، داروهای ضد سل و داروهای ضد رتروویروسی برای بیشتر آنتیبیوتیکها با فعل و انفعالات دارویی قابلتوجه در نظر گرفته میشوند. تداخلات پیچیده دارویی میتواند با این داروها رخ دهد: برای مثال، داروی آنتی رتروویرال ایتراویرین به طور همزمان یک سوبسترا، یک مهار کننده، و یک القاکننده آنزیمهای متابولیزه کننده دارو است!
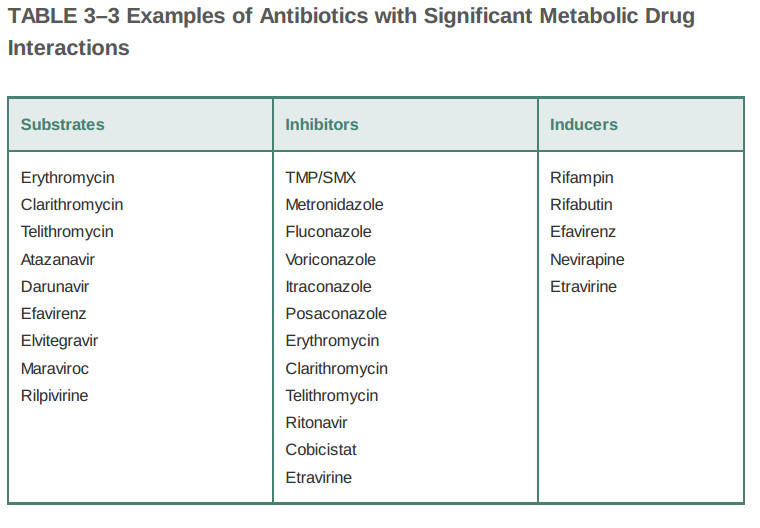
جدول ۳ - ۳: مثالهایی از آنتیبیوتیکها با مداخلات دارویی متابولیک مهم